規制管理
構造化コンテンツによるドキュメント・オーサリングの変革
薬事申請におけるデータ中心性、デジタル化、自動化を実現
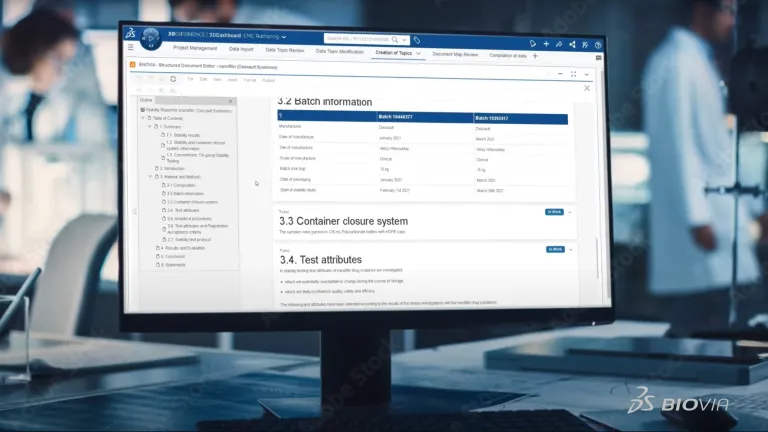
規制情報管理は、スポンサーがコンテンツを正確かつ容易に共有し、関連するグローバルな規制機関と協調できるようにするために不可欠です。ダッソー・システムズは、この重要なコンテンツを自動生成するためのデータ主導型でモデルベースのアプローチを提供することで、申請管理を変革しています。スポンサー企業のデータ・レイクまたは個々のシステムから重要なデータを取得し、関連する CMC の表、グラフ、重要な説明文を生成できるようになりました。FDA の KASA のようなイニシアチブが意味していることは、業界が今、ラボ・システムで行っている、Word ベースの切り貼り式の従来のやり方から脱却し、AI を活用する方法に切り替えるようにすべきということです。
当社の CMC オーサリング・ソリューションは、単にデータを提供するだけでなく、ソースへの完全なトレーサビリティー、データを動的に更新する機能、別々の地域/提出物間でのコンテンツの再利用、すべてのコンテンツ要素を集めて「使用できる場所」、オーサリング・グループ間のリアルタイムのコラボレーション、CMC およびその他の申請モジュールへの変更管理および更新を推進する、他にはない機能を提供します。この完全な能力を備えた SaaS ソリューションは、最新の AI および構造化コンテンツ・オーサリング技術を活用しています。
BIOVIA の規制管理ソフトウェアの主なメリット
コンプライアンス
手作業によるミスを減らし、データや文書の一貫性と完全性を確保し、データのトレーサビリティーと「設計によるデータの整合性」を保証し、データ形式を含む行政機関(FDA、EMA など)の要件に対応し、申請後に問題が起きる可能性を減らします
時間と予算
手作業や付加価値のない作業を減らし、各アプリケーションのデータに対する手作業によるデータ照会を減らし、データ検証の繰り返しの承認を排除し、レビュー・サイクルを短縮し、当局への対応時間を短縮します
コラボレーション
複数システムの複雑さの解消、ドキュメントに対する同時作業、構造化されたコンテンツに基づく知識の共有、社内業務の正式化と調和、新しいパートナー、サプライヤー、顧客の統合を実現します
SaaS クラウド・ソリューション
BIOVIA の規制情報管理ソリューションは、3DEXPERIENCE プラットフォーム上で稼動し、データ中心の AI 主導で薬事申請用ドキュメントを自動生成するというメリットを提供します。
主なメリット:
- 手作業による転記(コピー & ペースト)を排除してドキュメント作成を加速
- ドキュメント自動生成により正確なレポートの作成
- トレーサビリティーとソース・データへの直接アクセスにより、透明性を最大化
- セキュアなクラウドベースのコラボレーション環境で IP を保護
CMC 関係書類の作成の転換
データ中心の CMC 関係書類作成アプローチに移行することで、ドキュメント作成を合理化できます。BIOVIA Structured Document Authoring は、標準化された書式設定、コンテンツ自動更新、安全なコラボレーションにより、文書作成にかかる時間とコストを削減します。
医療機器・医薬品向け規制情報管理システムに関する FAQ
その他の情報
BIOVIA の活用方法
組織の規模の大小を問わず、シームレスなコラボレーションと持続可能なイノベーションに、このソリューションがどう役立つかについて、BIOVIA エキスパートがご説明します。
始めましょう
学生、教育機関、専門家、企業向けのさまざまなコースとクラスがあります。お客様に最適な BIOVIA トレーニングを見つけてください。
サポートを利用する
ソフトウェアおよびハードウェアの認証情報、ソフトウェアのダウンロード、ユーザー・ドキュメント、サポート窓口、ならびに提供サービスに関する情報をご確認ください。