QUMAS EDMS
クラウドベースの電子文書管理
データ中心の文書管理アプローチ
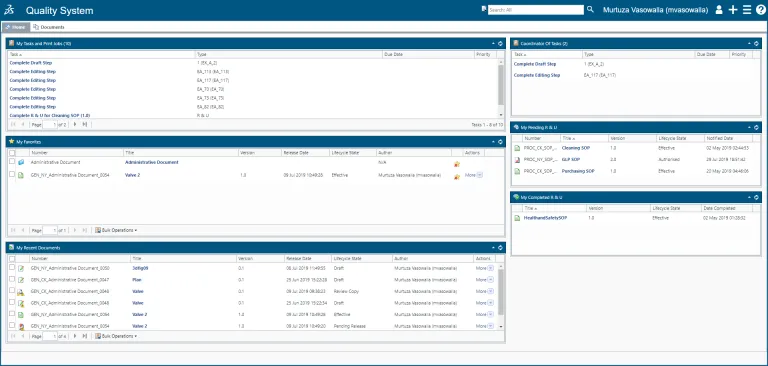
ドキュメントおよび記録されたデータは、品質とコンプライアンスの基礎です。しかし、紙ベースのドキュメントを利用する組織は品質データを真に活用することができず、変化する規制要件に合わせて迅速に品質ドキュメントを適応させることができません。BIOVIA QUMAS EDMS により、従来のドキュメント管理から高度な品質コンテンツ管理に移行できます。BIOVIA QUMAS EDMS は、データ中心のクラウドベースの電子文書管理ソフトウェア・ソリューションで、データと文書の管理、SOP 管理、および関連トレーニングのための実績のある法規制コンプライアンス方法をビジネス全体に提供します。QUMAS EDMS は FDA 21 CFR Part 11 (連邦法第 21 章第 11 条)に準拠する文書管理システムです。
BIOVIA QUMAS 文書管理を使用することで、グローバルな規制指令に準拠して、ポリシー、標準作業手順書(SOP)、作業指示書、マニュアル、ファイル、レポートを必要な時に作成して管理することができます。Word 文書などのコンテンツをユーザー・インターフェースにドラッグ&ドロップすることで、ドキュメントを簡単に作成できます。ソリューションの高度なデータ中心アプローチにより、ドキュメントの作成、検索、管理が容易になります。
ユーザーの実績
-
SOP 管理のコストが 20~40% 低下
-
SOP レビューの時間が 20~30% 短縮
-
文書化にかかる時間が 30% 短縮
-
正確な申請が 60% 増加
BIOVIA QUMAS EDMS の機能のご紹介
- エンタープライズ・コンテンツ管理
- 電子文書管理
- 学習管理システム - LMS
- バッチ・データ管理
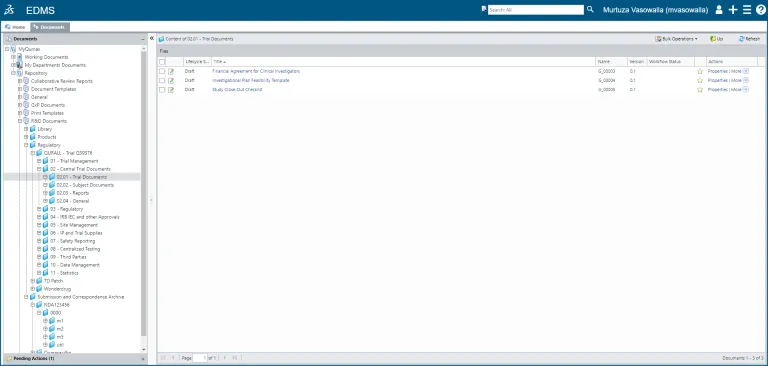
コンテンツの作成から、編集、レビュー/承認、およびハードコピー管理、延長と廃棄のスケジュールまで、ドキュメント(またはドキュメントのセット)の全ライフサイクルを管理します。
電子化コモン・テクニカル・ドキュメント(eCTD)、非 eCTD および薬事申請、CMC (医薬品および原薬)、臨床、非臨床および品質のための、ポリシー、標準業務手順書(SOP)、作業指示およびマニュアルを作成し、管理します。
コンプライアンスのトレーニングと管理のプロセス、またはインタラクティブなコーポレート・コンプライアンス・トレーニングの実施、追跡、管理を自動化します(NetDimensions を利用)。
以下の専用の機能で、大量のドキュメントを効率的に処理します。
- Enterprise Scanning
自動スキャンにより、旧来の紙文書をメタデータ付きの電子文書に変換し、照合および長期保存のためのカバー・ページの作成と印刷を行います。 - Document Transfer (DocTransfer)
データ・インテグリティを維持したメタデータ定義により、異なるアプリケーションからの複数のドキュメントの自動での一括登録や、ファイル・システムからファイル・セットをドラッグ & ドロップできます。 - Content Cache
広範囲にアクセスされる文書のうち、よく使用されるドキュメントをローカル・キャッシュに保存して、ネットワーク・パフォーマンスを向上させます。
SOP 管理
QUMAS EDMS は、グローバル・ネットワーク上で SOP の作成、共有、配布、管理を自動化し、SOP のライフサイクルを記録します。
- バージョンを比較して、更新箇所の確認を容易にします。
- 最新と更新中の SOP にアクセスできます。
- コンテンツを検索して、権限に応じて表示および印刷できます。
- 使用しているバージョンが、監査証跡に完全に準拠する管理された最新のドキュメント・バージョンであることを保証します。
- 手順管理に関するすべての cGxP 要件および 21 CFR Part 11 に準拠していること。
eCTD および申請管理
薬事申請の電子化コモン・テクニカル・ドキュメント(eCTD)は複雑で、時間がかかるプロセスです。システム化されていない環境での申請作業は、新薬の上市に遅れが生じ、特許権が切れるまでの収益期間が短くなります。
BIOVIA QUMAS は、以下の機能を 1 つにまとめたソリューションです。
- テンプレートベースのコンテンツ・オーサリングと管理
- 薬事、臨床、非臨床、品質に関するリアルタイムのコラボレーションと申請管理
- FDA、EMA、または PMDA などの規制機関に対する、規制に準拠した方法での自動化された電子提出(CTD、eCTD、NeeS、IMPD、CTA、eNTA、VNeeS 形式を含む)
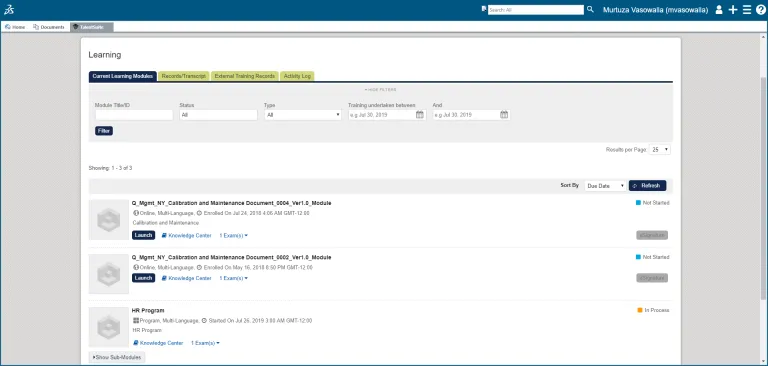
学習管理
従業員は該当する SOP のトレーニングを受けて、習熟度や理解度を確認できます。
各従業員には、割り当てられたトレーニング・タスク、未実施のトレーニング・タスク、および完了したトレーニング・タスクの全履歴が記録されます。
管理レポートとダッシュボードからは、個人および部門のトレーニング、資格認定のステータスを明確に把握でき、証拠と記録によって規制当局に説明できます。
Industry Process Accelerators - IPA
BIOVIA QUMAS EDMS の Industry Process Accelerators には、専用の設定、ドキュメンテーション(バリデーション・パック、設計文書、システム・アクセス計画など)、プロフェッショナル・サービス(インストール、エンドユーザーおよびトレーナー向けトレーニング)、運用開始後 3 ヵ月以上のプロフェッショナル・サービス・レビューが含まれます。これには、設定、文書化、検証スクリプト、および設計文書が含まれます。
- 品質保証文書 IPA
- 研究開発提出書類
品質保証文書 IPA
品質保証(QA)文書のライフサイクル管理をサポートします。設定は、広く取り入れられているビジネス利用をベースに QA 利用向けとなっています。プロシージャー、メソッド、仕様、法規制、一般の 5 つの GxP 文書タイプと、承認管理向けの 5 つのワークフローがあります。
研究開発提出書類 IPA
世界の規制当局への申請をサポートします。設定は R&D 向けの、DIA EDM リファレンスモデルと CTD 規格に準拠しています。CMC の医薬品、 原薬、仕様、臨床および非臨床などの 14 種類の文書タイプがあります。
さあ、始めましょう
医薬品の品質の世界は変化しています。BIOVIA で一歩先を行く方法を発見しましょう。
その他の情報
BIOVIA の活用方法
組織の規模の大小を問わず、シームレスなコラボレーションと持続可能なイノベーションに、このソリューションがどう役立つかについて、BIOVIA の担当技術者がご説明します。
始めましょう
学生、教育機関、専門家、企業向けのコースとクラスをご用意しています。お客様に最適な BIOVIA トレーニングを受講してください。
サポートを受ける
ソフトウェアやハードウェアの資格認定、ソフトウェアのダウンロード、ユーザー・マニュアル、サポート連絡先、サービス・オファリングに関する情報を入手できます。