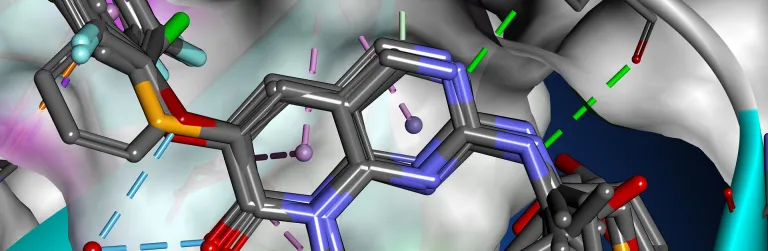
構造ベースの設計
構造ベースおよびフラグメントベースの設計をサポートする包括的でスケーラブルな科学ツール群
ヒット化合物の発見から後期段階の最適化までの創薬を促進
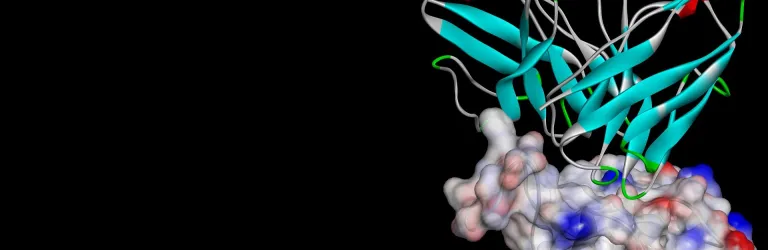
構造ベースの設計(SBD)と関連するフラグメントベースの設計(FBD)は、低分子医薬品の合理的な設計における定評ある戦略です。低分子がどのようにタンパク質に結合するかという知識は、早期スクリーニングにおける化合物の優先順位付けから、活性や選択性の最適化の過程に至るまで、非常に有利な立場をもたらします。
BIOVIA Discovery Studio は、Cambridge Crystallographic Data Centre (CCDC)の GOLD をはじめとする、包括的でスケーラブルな科学ツール群を提供し、ヒット化合物の発見から後期のリード化合物の最適化までの SBD および FBD 戦略をサポートし、支援します。
- 準備
- スクリーニング
- スコア
- 拡張
準備
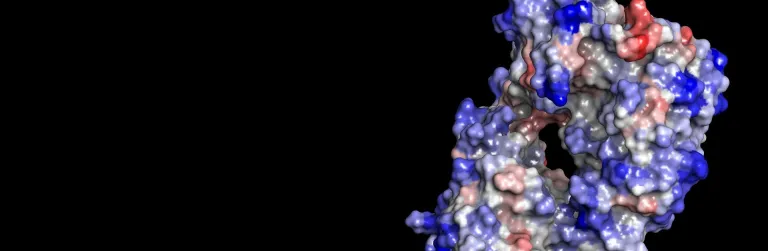
- 3D 構造(PDB、X 線構造、ホモロジー・モデルなど)を解析して SBD 向けに準備
- 結晶充填に基づいて隣接する分子を自動的に構築し、相互作用を解析
- 選択した pH で残基のイオン化状態を予測
- 推定されるリガンド結合部位を特定して解析
- リガンドの広範な特性や 3D 座標を計算
- リガンドのコンフォメーションを生成
- 薬物類似性や分子の特性に基づいてリガンドをフィルタリング、あるいは望ましくない官能基や特徴を持つものを除外
スクリーニング
- ヒット同定と最適化
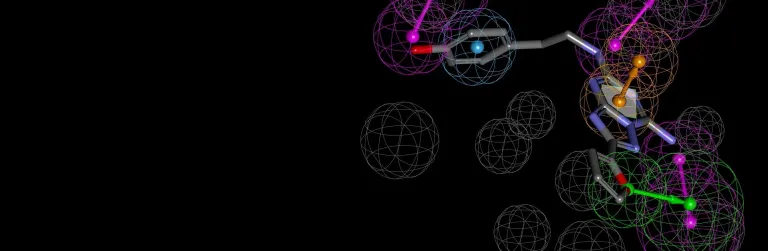
- CATALYST ファーマコフォア・エンジン、あるいは LibDock または CDOCKER ドッキング・アプローチのいずれかを使用して、リガンドやフラグメントに対する仮想スクリーニングを実行
- GOLD § でドッキングを実行
- 古典的な化学反応式と市販の試薬を使用して、タンパク質中でリード最適化を実行
- 市販の化合物から切り出した分子フラグメントを使用してスキャフォールド・ホッピングまたは R グループ置換をタンパク質中で実行
§ Cambridge Crystallographic Data Centre からのライセンスが必要
スコア
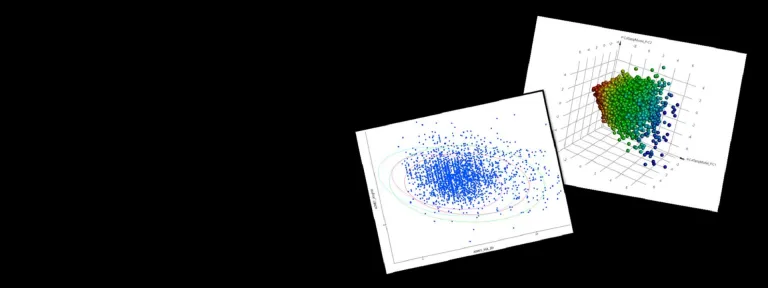
- MM-PBSA または MM-GBSA CHARMm ベースの手法で結合エネルギーを計算
- 自由エネルギー摂動(FEP)法を使用して、同種のリガンドの相対的なリガンド結合エネルギーを正確に予測
- Multi-Site Lambda Dynamics (MSLD)で、リガンドのコンビナトリアル・ライブラリの相対自由エネルギーを計算
- 望ましい、望ましくない、および満たされていない非結合相互作用モニターの総合的なセットを使用して、相互作用する重要残基を同定
- スクリーニング・ヒットをプロファイリングして優先度を付け、効能と標的特異性を最適化
拡張
- 今後のスクリーニングの新しい開始点として、コンビナトリアル・ライブラリを設計して最適化
- 従来の QSAR、フィンガープリント、量子力学ベースの記述子をスコアに紐づけて、高度な予測モデルを作成
- TOPKAT を使用して毒性を最小化し、薬物動態プロファイルを最適化
さあ、始めましょう
BIOVIA Discovery Studio で創薬を加速しましょう。
BIOVIA の創薬および開発のコミュニティの会話に参加しましょう!
その他の情報
BIOVIA の活用方法
組織の規模の大小を問わず、シームレスなコラボレーションと持続可能なイノベーションに、このソリューションがどう役立つかについて、BIOVIA の担当技術者がご説明します。
始めましょう
学生、教育機関、専門家、企業向けのコースとクラスをご用意しています。お客様に最適な BIOVIA トレーニングを受講してください。
サポートを受ける
ソフトウェアやハードウェアの資格認定、ソフトウェアのダウンロード、ユーザー・マニュアル、サポート連絡先、サービス・オファリングに関する情報を入手できます。