Aire oncologie
Mieux comprendre et soigner les cancers avec MEDITWIN.
Mieux cerner la maladie
En 2018, le cancer était la deuxième cause de perte d'années de vie en bonne santé (DALYs) au rang mondial, et était responsable d'environ 1 décès sur 6 [1-2]. Entre 2010 et 2019, le nombre de nouveaux cas de cancer dans le monde a augmenté de 26,3 % et le nombre de décès de 20,9 % [2].
Les jumeaux virtuels expérimentés dans les pratiques en oncologie contribuent à augmenter l’expertise des équipes professionnelles et des personnes, en permettant notamment de :
Combiner les informations pour prédire l’effet des interventions
Pourquoi caractériser le stade d’évolution d’un cancer ?
Lors du diagnostic d’un cancer, la prise en charge dépend de l'extension de la maladie dans l’organisme et de son profil biologique, c’est l’étape de stadification.
Il est essentiel de combiner des informations toujours plus complexes issues d'un bilan comportant des examens de biologie, d'imagerie, et d'endoscopie couplés à des biopsies.
Le stade caractérise le développement de la maladie dans l’organe principal, dans les ganglions lymphatiques, et dans les organes distants de l’organe principal.
L’effet des traitements dépend du stade (et du profil biologique). C’est pourquoi le stade permet de planifier les interventions chirurgicales ou radiologiques, la radiothérapie et les traitements médicamenteux et de les ajuster au cas par cas dans un échange multidisciplinaire.
Les jumeaux virtuels permettraient d’appliquer cette connaissance à chaque personne. L'objectif du projet MEDITWIN est donc de créer des représentations virtuelles de la maladie pour aider à la stadification et à la planification des interventions.
Quelles sont les difficultés liées à la prise en charge des individus atteints par cette pathologie ?
- Les standards internationaux pour la stadification du cancer sont indispensables mais complexes à mettre en œuvre en l’absence de solution numérique. Un patient doit passer un nombre important d'examens (endoscopie, IRM, scanner, biopsies, etc.). Ces examens sont de plus en plus nombreux et de plus en plus longs à analyser, et ils ne sont pas revus par le même médecin. La compréhension et la prise en compte de toutes ces données multimodales et multi échelles sont un enjeu pour les professionnels de santé et pour les patients.
- Les interventions doivent être personnalisées. C’est le cas de la destruction par la chaleur ou thermo-ablation de métastases hépatiques, nécessitant une personnalisation et une expertise clinique de haut niveau. La prise en compte de nombreux paramètres pour ajuster la technique, notamment la taille de la lésion, la proximité de gros vaisseaux, le type d’énergie utilisée pour créer la chaleur nécessite une grande expertise. Il faut également une bonne connaissance de la tumeur et de sa vitesse de croissance.
Afin d’illustrer concrètement ce parcours thérapeutique personnalisé, nous présentons ci-après des extraits vidéo correspondant aux différentes étapes clés de l’intervention : planification, guidage, ablation et contrôle post-procédure.
Ces vidéos proviennent de cas réels réalisés sur la plateforme d'expérimentation préclinique labellisée BPL (Bonnes Pratiques de Laboratoire) à l’Institut Hospitalo-Universitaire (IHU) de Strasbourg, sous la supervision du Dr Juan Verde [3-4].
Extraits vidéo illustrant les principales étapes du parcours thérapeutique personnalisé
Qu’apportent les jumeaux virtuels du projet MEDITWIN ?
Les jumeaux virtuels du projet doivent aider à définir la meilleure stratégie thérapeutique pour chaque personne. Ils permettent l’intégration de multiples modalités d’examens médicaux et l’exécution de scénarios virtuels. Les études s’intéresseront aux traitements des personnes vivant avec un cancer du colon et du rectum, mais leurs principes sont applicables pour la presque totalité des cancers.
Trois équipes-projets Inria sont impliquées aux côtés de Dassault Systèmes pour la création de ces jumeaux virtuels :
L'équipe-projet MIMESIS se spécialisera dans les simulations biomécaniques multi-physiques temps réel, en utilisant notamment la méthode des éléments finis lissés et la simulation pilotée par données (assimilation d'images médicales, recalage 3D multimodal). Ces modèles biomécaniques permettront une visualisation dynamique et prédictive des interventions oncologiques sur le foie (ablation thermique des métastases hépatiques). Ainsi, l’équipe assistera la prise de décision chirurgicale en garantissant précision et sécurité accrues lors des traitements locorégionaux.
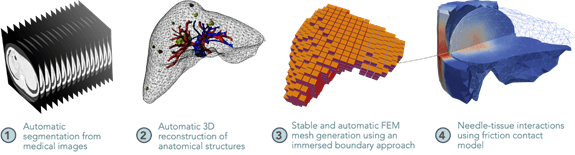
L’équipe-projet MONC (Modélisation en ONCologie) construira des modèles mathématiques de croissance tumorale basés sur des équations aux dérivées partielles couplées à des méthodes statistiques avancées pour l’assimilation des données (imagerie médicale, données biologiques et génétiques). Ces simulations numériques, calibrées à partir de données patient-spécifiques, permettront d’anticiper la progression tumorale, l'apparition de métastases et la réponse thérapeutique individuelle, améliorant ainsi la stratification clinique et la personnalisation des traitements oncologiques.
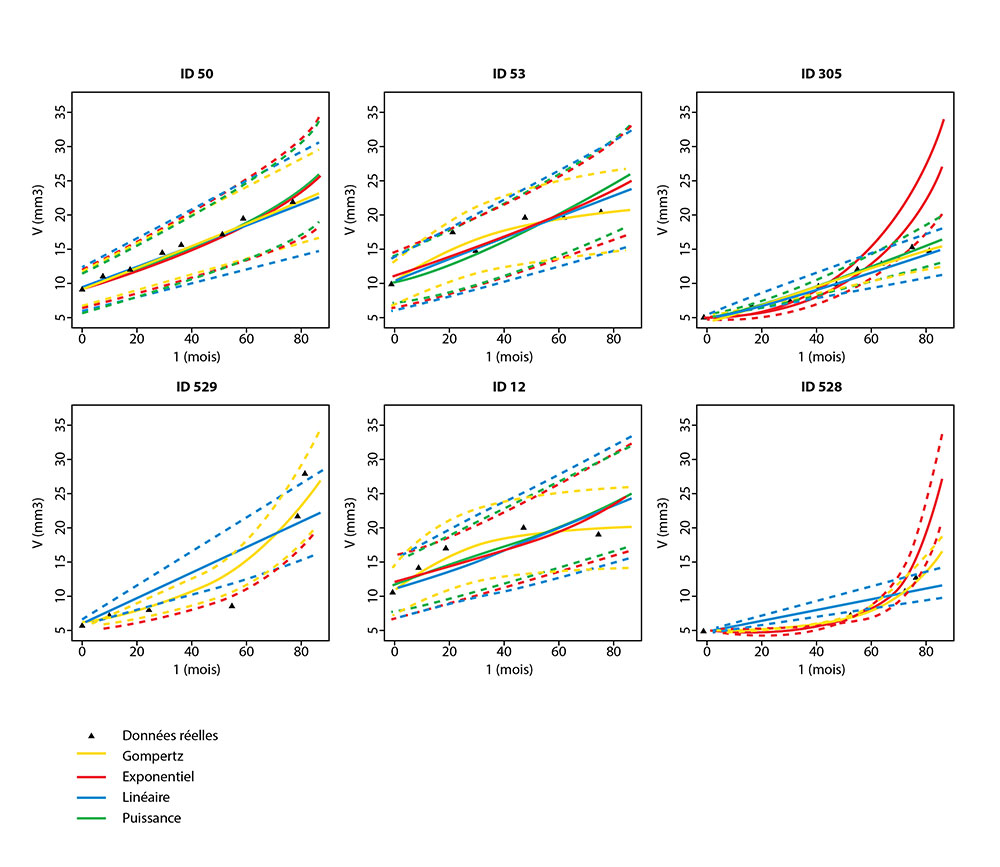
Comparaison de modèles mathématiques de croissance tumorale avec des observations individuelles
L’équipe-projet HEKA apportera une solution de support aux décisions pluridisciplinaires dans des phases de diagnostic, de traitement et de suivi des cancers à partir d’un jumeau virtuel reconstruit sur la base d’imagerie de tout ou une partie du corps, d’histopathologie, de marqueurs biologiques, cliniques et génétiques de patients, de la tumeur et d’organoïdes de la tumeur.
Développer des outils de médecine de précision pour le cancer
Qu’est-ce que la médecine de précision ?
Le cancer est une maladie complexe qui évolue dans le temps et dans l’espace.
L'orientation actuelle vers une médecine de précision reconnait l'importance de la biologie de chaque cancer. Cette nouvelle pratique recommande d'étudier les informations génétiques, immunitaires et de l’environnement du cancer pour identifier un traitement approprié.
Ainsi, les traitements utilisés sont mieux ciblés et sont adaptés à chaque personne.
Quelle sera l’expérience de médecine de précision avec MEDITWIN ?
Le projet MEDITWIN vise à cartographier le profil de chaque cancer et à prendre en compte toutes les données du patient (multi-échelles, biologiques, psychologiques, sociales etc.) pour le choix de nouvelles thérapies ou la participation à un essai thérapeutique.
L'information des patients et leur prise en charge est facilitée par la représentation de la connaissance médicale intégrée aux données individuelles pour présenter aux patients les options thérapeutiques adaptées à leur situation avec des niveaux de preuve établis par les connaissances scientifiques les plus récentes.
Pourquoi un projet de recherche sur les organoïdes ?
Les organoïdes sont des cultures in vitro de cellules tumorales extraites des biopsies. Ils permettent de tester in vitro de potentiels traitements avant d'être administrés chez un patient. Les organoïdes sont une voie de recherche prometteuse pour la médecine de précision.
Alors que les tests in vitro sont lents et coûteux, la création d’organoïdes virtuels permettrait de tester un grand nombre de traitements possibles, de sélectionner lesquels tester sur les organoides in vitro, et de donner accès aux organoïdes à plus de patients.
Références